為全面反映2022年我國醫療器械不良事件監測工作情況,國家藥品不良反應監測中心編撰了《國家醫療器械不良事件監測年度報告(2022年)》。
一、醫療器械不良事件監測工作進展
2022年,落實“四個最嚴”總體要求,嚴格按照《醫療器械不良事件監測和再評價管理辦法》(以下簡稱《辦法》)有關規定,堅持“科學評價為基礎,風險管理為主線,服務患者為中心”,持續加強制度體系建設,探索醫療器械警戒制度研究,不斷拓展宣傳培訓方式,深入研究監測評價新工具、新標準、新方法,全面提升風險預警和處置能力,醫療器械不良事件監測工作取得了新的進展:
(一)持續夯實報告收集基礎,繼續擴大系統覆蓋用戶
2022年,國家醫療器械不良事件監測信息系統接收到醫療器械不良事件報告69萬余份,每百萬人口平均報告數為493份。28個省(自治區、直轄市)的醫療器械不良事件報告縣級覆蓋率達到100%。醫療器械不良事件監測信息系統基層注冊用戶數量持續提升,達到39萬余家,其中醫療器械注冊人達31,648家。
(二)系統開展產品風險評價,全面推進重點監測工作
2022年,全國醫療器械不良事件評價處置工作持續開展,系統運用日常監測、預警分析及季度匯總等手段,確保及時發現、評價并處置風險。對國外監管機構采取的風險控制措施進行監測,根據發現風險的情況,全年共發布12期《醫療器械警戒快訊》。按工作方案要求全面推進重點監測工作,審核37個醫療器械品種不良事件重點監測實施方案,認定105家第一批國家醫療器械不良事件監測哨點,組織召開重點監測專家研討及工作推進會,全方位保障重點監測工作的順利開展。
(三)廣泛進行宣傳培訓,持續開展專項檢查
2022年,國家藥品不良反應監測中心與中國醫療器械行業協會合作舉辦了第六屆中國醫療器械警戒大會,舉辦了1期醫療器械不良事件監測核心技術研修班,配合國家局開展家用醫療器械座談會,吸引了知名學者、業界專家、企業代表、監測從業人員、用械人群的廣泛參與和討論。國家藥品不良反應監測中心組織對18家企業開展了醫療器械不良事件監測專項檢查,并督促醫療器械注冊人備案人對檢查發現的缺陷完成整改。
(四)深入探索警戒制度研究,積極參與國際交流合作
2022年,國家藥品不良反應監測中心承擔中國藥品監管科學行動計劃第二批重點項目醫療器械警戒技術和方法研究,聚焦醫療器械警戒制度研究和高風險、植入類醫療器械主動監測中的關鍵技術,持續提高警戒智能化和現代化監測評價能力。國家藥品不良反應監測中心積極參加國際醫療器械監管機構論壇(IMDRF)相關會議,有序開展“國家監管機構報告(NCAR)”信息交換工作,持續跟蹤“不良事件術語和編碼(AET)”項目組工作進展,促進醫療器械不良事件監測工作國際交流與合作。
二、全國醫療器械不良事件報告總體情況
(一)年度報告總體情況
1.全國醫療器械不良事件報告數量。2022年,國家醫療器械不良事件監測信息系統共收到醫療器械不良事件報告694,866份,比上年增加6.79%(圖1)。
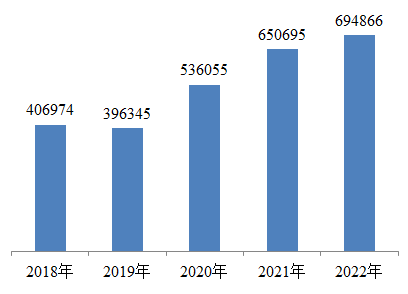
圖1 2018-2022年全國醫療器械不良事件報告數量

2.每百萬人口平均報告數量。2022年,我國每百萬人口平均醫療器械不良事件報告數為493份,比上年增加6.94%(圖2)。
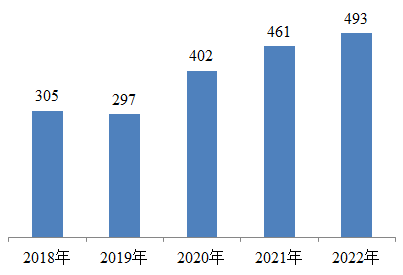
圖2 2018-2022年全國每百萬人口平均醫療器械不良事件報告數比較
(二)注冊基層用戶數量
截至2022年12月31日,在國家醫療器械不良事件監測信息系統中注冊的基層用戶(包括注冊人和備案人(以下簡稱注冊人)、經營企業和使用單位)共397,561家,比上年增長5.43%。其中注冊人31,648家,比上年增長7.51%,占用戶總數的7.96%;經營企業234,836家,比上年增長7.06%,占用戶總數的59.07%;使用單位131,077家,比上年增長2.17%,占用戶總數的32.97%(圖3)。
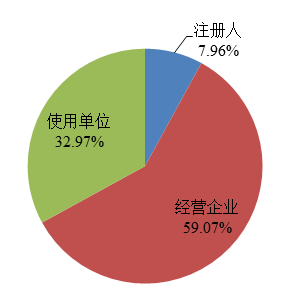
圖3 2022年國家醫療器械不良事件監測信息系統注冊基層用戶情況
注:《辦法》要求注冊人“應當注冊為國家醫療器械不良事件監測信息系統用戶,主動維護其用戶信息,報告醫療器械不良事件”。國家和省級監測機構開展培訓、檢查等工作,督促注冊人在系統注冊并維護產品信息,這是注冊人開展醫療器械風險評價落實主體責任的前提。
三、全國醫療器械不良事件報告統計分析
(一)按報告來源統計分析
2022年,國家藥品不良反應監測中心收到的醫療器械不良事件報告中,使用單位上報607,551份,占報告總數的87.43%;注冊人上報16,100份,占報告總數的2.32%;經營企業上報70,877份,占報告總數的10.20%;其他來源的報告338份,占報告總數的0.05%(圖4)。
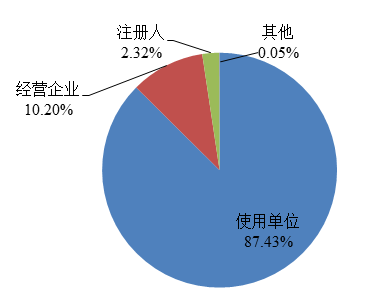
圖4 2022年醫療器械不良事件報告來源情況
(二)按事件傷害程度統計分析
上報死亡的可疑不良事件報告153份,占報告總數的0.02%,未發現不良事件與涉及醫療器械存在明確相關性;上報嚴重傷害的可疑不良事件報告45,012份,占報告總數的6.48%;上報其他傷害的可疑不良事件報告649,701份,占報告總數的93.50%(圖5)。
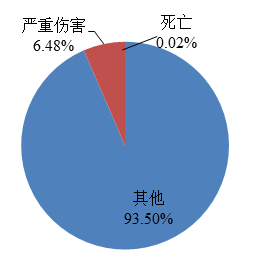
圖5 2022年醫療器械不良事件報告涉及事件傷害程度情況

(三)按醫療器械管理類別統計分析
2022年,國家藥品不良反應監測中心收到的醫療器械不良事件報告中,涉及Ⅲ類醫療器械的報告244,154份,占報告總數的35.14%;涉及Ⅱ類醫療器械的報告329,732份,占報告總數的47.45%;涉及Ⅰ類醫療器械的報告58,057份,占報告總數的8.36%;未填寫醫療器械管理類別的報告62,923份,占報告總數的9.06%。(圖6)。
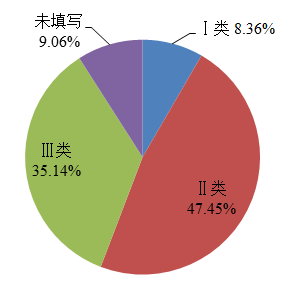
圖6 2022年醫療器械不良事件報告涉及醫療器械管理類別情況

(四)按醫療器械分類目錄統計分析
2022年,國家醫療器械不良事件監測信息系統收到的醫療器械不良事件報告涉及了醫療器械分類目錄中的所有類別。其中,報告數量排名前十位的醫療器械類別見表1。
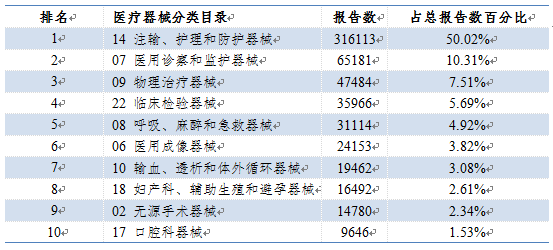
表1 2022年醫療器械不良事件報告涉及醫療器械分類目錄情況
(五)按醫療器械結構特征統計分析
2022年,國家藥品不良反應監測中心收到的醫療器械不良事件報告中,涉及無源醫療器械的報告448,422份,占報告總數的64.53%;涉及有源醫療器械的報告178,003份,占報告總數的25.62%;涉及體外診斷試劑的報告5,513份,占報告總數的0.79%;未填寫醫療器械結構特征的報告62,928份,占報告總數的9.06%(圖7)。
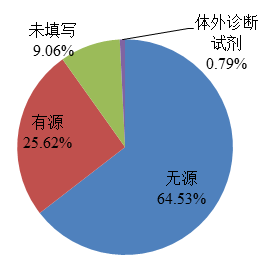
圖7 2022年醫療器械不良事件報告涉及醫療器械結構特征情況
(六)按實際使用場所統計分析
2022年,國家藥品不良反應監測中心收到的醫療器械不良事件報告中,使用場所為“醫療機構”的報告614,059份,占報告總數的88.37%;使用場所為“家庭”的報告64,696份,占報告總數的9.31%;使用場所為“其他”的報告16,111份,占報告總數的2.32%(圖8)。
圖8 2022年醫療器械不良事件報告涉及實際使用場所情況
四、醫療器械警戒快訊發布情況
2022年,國家藥品不良反應監測中心密切跟蹤全球醫療器械監管情況,發布12期《醫療器械警戒快訊》,匯總了美國、英國、澳大利亞以及加拿大發布的包括呼吸機、吻合器、覆膜支架、除顫儀、新型冠狀病毒檢測試劑等醫療器械在內的共86條安全性信息,為我國開展相關醫療器械的安全性評價和風險控制提供參考借鑒。
五、有關情況說明
(一)與大多數國家一樣,我國醫療器械不良事件報告通過自發報告系統收集并錄入到數據庫中,即當懷疑某種事件可能與醫療器械有關時,就可以上報。受報告者主觀意識、經驗水平、認知程度、甚至所持立場等影響,醫療器械不良事件的報告可能存在片面性和局限性,如傷害程度判讀不準確、報告填寫不規范、信息不完善等,甚至將與醫療器械無關的事件也按照不良事件上報,因此統計結果可能與實際發生的醫療器械不良事件情況存在偏差。
(二)不同醫療器械的不良事件報告數量受使用數量、風險程度、報告意識等諸多因素影響,因此報告數量的多少不直接代表醫療器械不良事件發生率的高低或者風險嚴重程度。
(三)上述統計數據來源于國家醫療器械不良事件監測信息系統中2022年1月1日至2022年12月31日接收的數據,統計中由于四舍五入的進位規則,可能會出現百分比加和不等于100%的情況。
(四)本年度報告完成時,部分嚴重傷害醫療器械不良事件報告尚處在調查和評價的過程中,因此統計結果為統計時數據收集情況的真實反映,并不代表醫療器械安全性評價的最終結論。
小貼士
1.醫療器械:是指直接或者間接用于人體的儀器、設備、器具、體外診斷試劑及校準物、材料以及其他類似或者相關的物品,包括所需要的計算機軟件;其效用主要通過物理等方式獲得,不是通過藥理學、免疫學或者代謝的方式獲得,或者雖然有這些方式參與但是只起輔助作用;其目的是:
(1)疾病的診斷、預防、監護、治療或者緩解;
(2)損傷的診斷、監護、治療、緩解或者功能補償;
(3)生理結構或者生理過程的檢驗、替代、調節或者支持;
(4)生命的支持或者維持;
(5)妊娠控制;
(6)通過對來自人體的樣本進行檢查,為醫療或者診斷目的提供信息。
2.醫療器械不良事件監測:是指對醫療器械不良事件的收集、報告、調查、分析、評價和控制的過程。
3.醫療器械不良事件:是指已上市的醫療器械,在正常使用情況下發生的、導致或者可能導致人體傷害的各種有害事件。
4.死亡醫療器械不良事件報告:指患者最終結果為死亡的醫療器械不良事件報告。不表示患者的死亡與使用醫療器械有明確的關聯性。
5.醫療器械不良事件報告原則:報告醫療器械不良事件應當遵循可疑即報的原則,即懷疑某事件為醫療器械不良事件時,均可以作為醫療器械不良事件進行報告。報告內容應當真實、完整、準確。
導致或者可能導致嚴重傷害或者死亡的醫療器械不良事件應當報告;創新醫療器械在首個注冊周期內,應當報告該產品的所有醫療器械不良事件。
6.國家醫療器械不良事件監測信息系統注冊要求:注冊人、經營企業和二級以上醫療機構應當注冊為國家醫療器械不良事件監測信息系統用戶,主動維護其用戶信息,報告醫療器械不良事件。注冊人應當持續跟蹤和處理監測信息;產品注冊信息發生變化的,應當在系統中立即更新。鼓勵其他使用單位注冊為國家醫療器械不良事件監測信息系統用戶,報告醫療器械不良事件相關信息。
(文章來源于互聯網)





 全部商品分類
全部商品分類















