5月6日,GE醫(yī)療宣布收購了專注于體內(nèi)腫瘤和神經(jīng)學生物標志物的Zionexa公司。GE醫(yī)療表示,其目標是開發(fā)Zionexa的生物標志物,以及最近獲得美國食品和藥物管理局批準的正電子發(fā)射斷層成像劑Cerianna。Cerianna被用作輔助活檢檢測雌激素受體陽性病變,以幫助告知治療選擇復發(fā)或轉移性乳腺癌患者,目前該交易的財務條款未披露。
Zionexa是體內(nèi)生物標志開發(fā)領域領航者

Zionexa成立于2018年,是體內(nèi)生物標志開發(fā)領域的國際領導者,指導腫瘤學的靶向治療,開發(fā)了體內(nèi)生物標記,指導治療選擇和監(jiān)測,改善患者的生活質量。在正電子發(fā)射斷層掃描中,生物標記可根據(jù)全身成像提供腫瘤的定位和特征,幫助腫瘤學家和核醫(yī)學醫(yī)師個性化治療。Zionexa團隊一半以上從事研發(fā)工作,以開發(fā)創(chuàng)新的分子成像體內(nèi)生物標記物,幫助臨床醫(yī)生對患者和療法進行分層,即在正確的時間為合適的患者找到準確的治療方法。
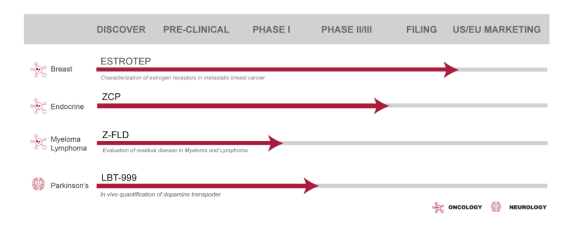
體內(nèi)生物標志物產(chǎn)品線
20年5月27日,美國Zionexa宣布FDA批準了該公司的產(chǎn)品Cerianna(氟雌二醇F18),Cerianna(氟雌二醇F 18)是一種分子顯像劑,被指定用于正電子發(fā)射斷層掃描(PET)成像,以檢測雌激素受體陽性病變,作為復發(fā)或轉移性乳腺癌患者活檢的輔助手段。組織活檢應用于確認乳腺癌的復發(fā)并通過病理學檢查ER狀態(tài)。Cerianna不能用于成像其他受體,例如人表皮生長因子受體2(HER2)和孕激素受體(PR)。
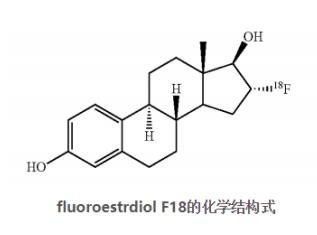
Cerianna是一種無菌、澄清、無色的靜脈注射溶液,活性成分氟雌二醇F18(fluoroestrdiol F18)是一種合成的雌激素類似物,一項納入了90名經(jīng)組織學證實為浸潤性乳腺癌女性的臨床試驗數(shù)據(jù)為此次批準提供支持。數(shù)據(jù)結果通過評分方式得出結果,在47例活檢陽性患者中,有36例影像學檢查陽性;在38例活檢陰性患者中,所有38例影像學均為陰性;11例影像學檢查假陰性的患者中,有10例活檢陽性。
20年12月9日,該公司宣布第一款Cerianna(Fluroroestradiol F -18)的劑量已分配給舊金山地區(qū)的兩個腫瘤成像中心。這兩種劑量的Cerianna代表著兩名乳腺癌患者能夠接受PET掃描的未來,這將對他們的治療過程產(chǎn)生更直接的影響,并總體上為他們提供更多的信息和更好的護理。
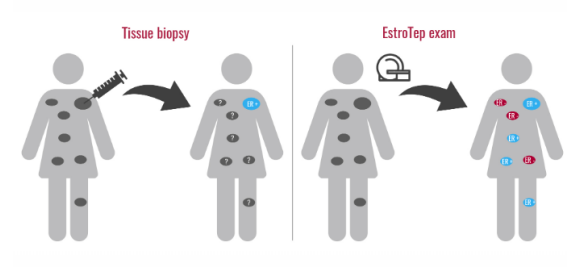
EstroTep / Cerianna,用于轉移性乳腺癌的創(chuàng)新體內(nèi)生物標志物
龐大的乳腺癌市場
乳腺癌是女性最常見的癌癥,每8位女性中就有1位被診斷出患有乳腺癌,2019年美國新病理估計人數(shù)高達271270, 2019年與乳腺癌相關的估計死亡人數(shù)高達42260,雖然90%的乳腺癌患者在診斷后可以存活五年,但其存活率在很大程度上取決于癌癥分期,乳腺癌的70%原發(fā)性腫瘤是雌激素受體陽性,轉移性乳腺癌,影響超過160000名患者的治療和診斷未獲得滿足,在美國,有30%的新乳腺癌患者最初處于IV 期或轉移期。轉移性乳腺癌的治療在很大程度上取決于患者雌激素受體的生物標志物狀態(tài)。
自2020年12月以來,Zionexa在美國市場上有了FDA批準的PET顯像劑Cerianna,但目前只有四分之一的4期乳腺癌的婦女可以使用。 GE的目標是通過2023年使至少四分之三的患者能夠使用Cerianna。GE 總裁兼首席執(zhí)行官凱文?奧尼爾表示:“與GE 醫(yī)療一樣,Zionexa的產(chǎn)品旨為患者提供更精確的診斷、更好的治療決策,最終獲得更佳的臨床結果。”
GE發(fā)力乳腺癌靶向治療
GE 總裁兼首席執(zhí)行官奧尼爾在新聞發(fā)布會上說 “此次收購進一步展示了我們對實現(xiàn)精確健康的承諾并提供創(chuàng)新,在癌癥患者的整個過程中,從初期篩查和診斷到告知治療選擇和監(jiān)測治療效果,為腫瘤專家、核醫(yī)學專家和其他醫(yī)生提供支持。
與此同時,Zionexa在法國和美國的24名員工都將轉移到GE ,GE還將在總部位于馬薩諸塞州馬爾堡的美國制藥診斷團隊中再招聘約 70 名專職員工。
來源:器械之家





 全部商品分類
全部商品分類













