01
納米技術多點開花
隨著納米技術在醫學領域廣泛應用,國際上已經有一些納米生物材料類醫療器械產品獲批上市。我國在2004年前后開始有納米材料醫療器械產品獲批上市,主要包括納米銀抗菌產品等。
在國家藥監局網站使用“納米”或“Nano”作為關鍵詞對國產醫療器械和進口醫療器械進行檢索,發現應用納米材料的醫療器械有效注冊證中,數量最多的是含有納米銀的敷料類產品,其他還包括含有“遠紅外納米級陶瓷粉”的納米穴位敷貼、含有“納米羥基磷灰石”的醫用納米羥基磷灰石/聚酰胺66復合骨充填材料、含有“NANOFILLED”填充材料的光固化樹脂封閉劑、采用“Nano Hybrid”填充材料的通用樹脂、含有“納米填充材料”的自酸蝕粘結劑及含有“Nano-coated” 的一次性使用鈍頭閉合切割手術器械等。
在體外診斷試劑方面,已有含有“碳納米管膠體金復合物”的人絨毛膜促性腺激素(HCG)快速檢測試劑盒,基于膠體金法的乙型肝炎病毒表面抗體檢測試劑、丙型肝炎病毒抗體檢測試劑盒及戊型肝炎病毒I gM抗體檢測試劑盒,基于膠體金法的嗎啡/甲基安非他明/氯胺酮/亞甲二氧基甲基安非他明/四氫大麻酚酸/可卡因聯合檢測試劑盒,基于納米順磁顆粒與化學發光結合的免疫分析技術新型冠狀病毒(2019-nCoV)抗體檢測試劑盒,以及基于膠體金法的新型冠狀病毒(2019-nCoV)抗體檢測試劑盒等產品獲批。
02
風險評估分層推進
由于納米材料的比表面積等因素不同,生物體暴露于納米材料后,可能表現出與常規材料不同的生物學反應。相較常規材料,納米材料在樣品制備時會有溶解性和分散性的區別,因此需要考慮納米材料在樣品制備時的特殊性。
納米材料被認為可能穿越人體所有保護屏障,包括血腦屏障和胎盤屏障等,因此使用納米材料時需要考慮納米材料的全身毒性,特別是中樞神經毒性和生殖毒性。例如,“納米分子冠”的形成可能會影響其生物響應、動力學、蓄積和毒性等生理效應;有些納米材料具有類佐劑特性,可能會對免疫系統產生影響,需要關注免疫毒性;血液中納米材料暴露時間間隔不同可能改變其毒代動力學特征等。基于此,針對應用納米材料的醫療器械的生物學評價內容,在兼顧常規醫療器械評價內容的基礎上,還應重點考慮與納米材料有關的其他問題,如樣品制備、吸收、分布、代謝和排泄/清除(ADME)、全身毒性、中樞神經毒性和免疫毒性等。
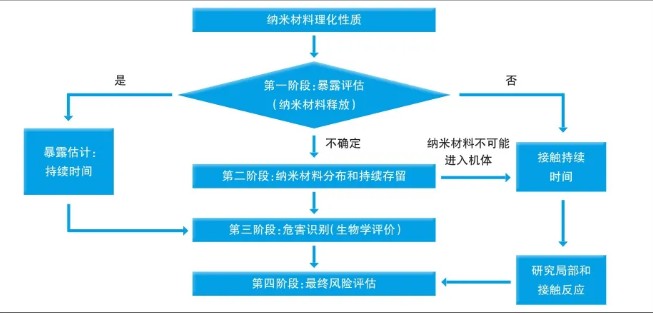
對應用納米材料的醫療器械進行風險評估,最重要的考量因素是納米材料從醫療器械中釋放的可能性,應按照GB/T 16886.1要求進行風險評估。與納米材料釋放相關的風險評估階段性方法包含四個階段(見圖)。
點擊查看大圖
第一階段:暴露評估(納米材料釋放)
第一階段的目的,是模擬臨床實際應用中最不利的情況下,基于材料的屬性和應用類型,以及醫療器械植入后的磨損情況,評估納米材料釋放的可能性和潛在暴露風險。
當納米材料存在釋放的可能性時,需要根據理化表征確定釋放材料的性質、釋放速率和可能對其產生影響的因素,進一步開展生物學評價。如果納米材料不存在釋放的可能性,進一步評價可以僅限于局部反應。如果納米材料存在潛在釋放的不確定性,應開展第二階段評估。
第二階段:納米材料分布和持續存留
這一階段的主要目的,是識別納米材料的生物分布和蓄積,可結合毒代動力學研究結果進行評估,以應對在第三階段潛在暴露場景中所需的生物學評價。
無創傷(皮膚接觸)和/或有創傷器械作用于人體部位所釋放的納米材料的吸收和接觸持續時間,對納米材料向其他器官的潛在分布具有重要影響,應進一步考慮納米材料在其釋放的生物介質中的持續存留/穩定性。
對于無創傷器械,首先需要評估納米材料進入全身循環的潛力,如果能夠得出在最差使用條件下,納米材料都不可能進入全身循環,則通常僅需考慮限于接觸部位的局部反應。對于有創傷器械,需要通過更詳細的毒代動力學研究,評估納米材料進入并保留在特定組織中的潛力。從以上研究中得出的結果,可能影響下一步生物學評價方法的選擇。
第三階段:危害識別(生物學評價)
如果第一階段和/或第二階段沒有識別出納米材料的釋放,醫療器械的局部效應可以被GB/T 16886.1中已有的試驗方法覆蓋;如果存在納米材料釋放,則需要附加試驗。如果根據第二階段評估結果,判斷納米材料釋放不太可能進入全身循環,則僅需進行局部效應的試驗;如果納米材料在一個或多個組織暴露,則應考慮附加試驗,如免疫毒性、ADME、遺傳毒性、亞慢性、慢性毒性、生殖毒性和神經毒性等試驗。為了評估納米材料的潛在風險,可能需要對現有的試驗方法進行改進。
第四階段:最終風險評估
當毒性由納米材料引起時,必須對劑量效應關系給予特別關注。對在研究中的毒性反應與在靶器官(內部暴露)中檢測到的納米材料水平進行比較,以評價風險。評估的風險可以與不含納米材料的醫療器械作對比,并根據YY/T 0316進行評估。除評估潛在風險外,在最終受益風險評價中也要考慮患者的潛在受益。
03
國際研究方興未艾
關于醫療器械中應用納米材料的評價方法、工具及手段目前均在研究中,并取得了一些進展。
在國際標準制訂方面,國際標準化組織納米技術委員會(I SO/TC229)正在研制的標準涵蓋納米技術相關術語和定義、納米顆粒的職業暴露、樣品準備、劑量考慮、毒理篩選方法、納米材料分散與聚集對毒理學的影響、納米器械產品中納米材料的釋放,以及采用3D細胞模型評價納米材料的毒性方法等。國際標準化組織醫療器械生物學評價技術委員會(ISO/TC194)僅發布1項納米相關技術報告:ISO/TR 10993-22:2017: Biological evaluati on ofmedicaldevices — Part 22: Guidance on nanomaterials(醫療器械生物學評價第22部分:納米材料指南)。該報告全面考慮了應用于醫療器械領域的納米材料及納米技術可能帶來的風險,并對如何評價這些風險給出了指導性建議,強調了在評估由納米材料組成、包含和/或生成納米材料的醫療器械的安全性時需要考慮的重要方面。作為一份技術報告,該文件明確了當前與納米材料相關的技術知識,但沒有列出詳細的測試方法。
在我國,全國納米技術標準化技術委員會(SAC/ TC279)已經發布112項納米技術相關標準,主要涉及納米材料術語、表征方法及指南等。但在生物學評價方面的技術內容仍然缺乏。已經發布的與醫療器械相關的標準包括:《GB/T 38261-2019:納米技術 生物樣品中銀含量測量 電感耦合等離子體質譜法》《GB/T 36083-2018:納米技術 納米銀材料 生物學效應相關的理化性質表征指南》《GB/T 34059-2017:納米技術 納米生物效應代謝組學方法 核磁共振波譜法》《GB/T 28044-2011:納米材料生物效應的透射電子顯微鏡檢測方法通則》《GB/T 20307-2006:納米級長度的掃描電鏡測量方法通則》。
全國醫療器械生物學評價標準化技術委員會(SAC/TC248)目前正在轉化國際標準“ISO 10993.22-2017:醫療器械生物學評價 納米材料指南”。
全國醫療器械生物學評價標準化技術委員會納米醫療器械生物學評價分技術委員會(SAC/TC248/SC1)已經開展的標準化工作包括“納米醫療器械生物學評價-納米銀敷料技術要求(2011年立項)”、YY/T 0993-2015《醫療器械生物學評價 納米材料:體外細胞毒性試驗(MTT試驗和LDH試驗)》、YY/T 1295-2015《醫療器械生物學評價 納米材料:細菌內毒素試驗》及YY/T 1295-2017《醫療器械生物學評價 納米材料 溶血試驗》。
在指導原則制訂方面,國家藥監局醫療器械技術審評中心(以下簡稱器審中心)牽頭,國家納米科學中心、廣東粵港澳大灣區納米技術創新研究院及中國食品藥品檢定研究院(以下簡稱中檢院)正在聯合編寫包括《醫療器械中應用的納米材料安全性和有效性評價框架指導原則(征求意見稿)》在內的系列指導原則。該系列指導原則在總體框架設計中,根據納米技術快速發展的實際情況,按照納米醫療器械安全性和有效性所涉及的評價領域,規劃了納米材料表征、體外替代測試/計算機模擬、生物相容性/毒理學評價、動物實驗以及應用真實世界數據的臨床和長期安全性評價等指導原則。該系列指導原則力求建立一個開放性框架,成為一個可以容納納米技術最新研究進展動態更新的評價體系,同時也在探索醫用材料評價方法、工具和手段方面的現代化路徑。目前,《應用納米材料的醫療器械安全性和有效性評價第一部分:體系框架》已完成編寫。
系統理解納米生物材料的生物學效應,建立納米安全客觀評價方法體系,建立標準化納米生物材料評價方法,既是納米科技的重要前沿,也是各個國家和地區納米科技可持續發展和保持國際競爭力的重要保障。我國在納米科技領域的發展十分迅速。為支持相關產品的安全性、有效性和質量可控性評價,我國在納米毒理學、基礎納米醫學、納米生物學等基礎研究領域取得了重大進展。
目前,國家納米科學中心與器審中心、中檢院共建國家藥監局納米技術產品評價重點實驗室。該重點實驗室結合國家納米科學中心的技術優勢、器審中心的監管科學研究和實際監管評價需求以及中檢院的醫療器械檢驗能力,建設優勢互補、學科交叉的納米醫療器械質量評價研究平臺。重點實驗室將圍繞納米科技產品/技術的有效性、產品質量、臨床前安全評價和標準研制推廣,盡快形成納米醫療器械相關技術要求,構建產品檢驗檢測體系,保障納米醫療器械安全性及有效性,支撐新產品和新產業的高速發展,確保新技術、新產品的快速安全應用,保證創新醫療器械技術盡快造福于民。
延伸閱讀
美歐納米產品監管科學研究進展
隨著納米技術和相關產品轉化研究的迅速發展,納米技術創新醫療產品的技術評價和監管對于全球各個國家和地區的監管機構都是一個挑戰。目前,納米技術產品相關標準與質量控制要求都處于研究和制訂過程中,這一現狀加大了監管機構對納米技術產品的監管難度,也制約了這一新技術和新產業的發展。
美國FDA成立了納米技術(特別)工作組(task force),主要負責監管包含食品、化妝品、藥品、醫療器械、動物相關產品在內的應用納米技術,或者包含納米材料的一系列產品。FDA與美國國家標準與技術研究院(NIST)、美國國家衛生研究院(NIH)、美國國家癌癥研究所(NCI)共同成立了納米表征實驗室(Nanotechnology Characterization Lab)。2011年,FDA開始組織研究、評價和出版納米相關產品的行業指南。第一個指南為工業指南草案。2012年,FDA組織發布了兩個關于食品和化妝品的新準則草案。2017年,FDA與白宮、美國國家納米技術委員會,以及其他美國政府機構和國際監管機構,集中協調科學數據共享和政策方法,以確保納米產品的安全性和有效性。2018年,FDA組織發布了納米材料遺傳毒性評估路線圖(Genotoxicity Assessment of Nanomaterials)。
歐盟也高度重視納米技術領域的監管科學研究。新興與新識別健康風險委員會(SCENIHR)是為歐盟委員會制定法規提供科學支持的機構。該機構于2015年1月制定了《醫療器械中應用的納米材料潛在健康效應指導原則》,這是全球第一份由監管機構制定的專門針對醫療器械中應用的納米材料安全性研究的指導原則。
來源/ 中國醫藥報
文/ 國家納米科學中心 竇凱飛
新媒體編輯:李易真
統籌策劃:何璇





 全部商品分類
全部商品分類













